细菌感染已导致诸多健康问题,传统抗生素的过量使用是细菌对抗生素产生耐药的主要原因,这为寻求新的抗菌制剂提出了迫切的需求。一氧化氮(NO)是一种内源性的亲脂分子,在许多生理学和病理学过程中起关键的调节作用,尤其对天然免疫系统中的抗感染起着关键性作用。NO分子及其与周围环境中的氧化剂发生反应生成的副产物过氧亚硝酸盐(ONOO-)和三氧化二氮(N2O3)易导致细菌膜的脂质过氧化作用,从而表现出显著的抗菌性能。同时,NO还能促进伤口愈合,增加肌成纤维细胞和胶原蛋白的产生。
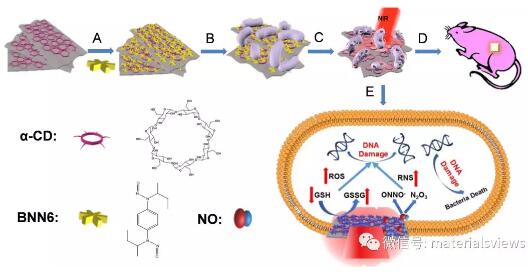
MoS2-BNN6纳米复合物的制备及其抗菌应用示意图:A: 环糊精修饰的MoS2纳米片负载BNN6;B: 细菌对MoS2-BNN6的有效捕获;C: 808 nm光触发NO释放并协同PTT快速、高效抗菌;D: PTT/NO协同抗菌机理中,光热过程中MoS2的催化功能促进了细菌内抗氧化剂谷胱甘肽GSH的氧化,增加ROS/RNS的同时降低了GSH的水平,从而加速了细菌DNA的损伤; E: 小鼠表皮炎症伤口的抗菌治疗中,NO的精准释放促进了肌成纤维细胞和胶原蛋白的形成并消除了伤口的炎症。
NO发挥药效的关键是如何实现NO的精准和高效控释。传统的NO缓释药物,NO浓度不可控,药物副作用明显,限制了其临床应用。纳米材料为NO有效负载和可控释放提供了新思路。例如,MoS2纳米片作为一种典型的二维过渡金属硫化合物,具有大的比表面积、表面易于修饰、良好的生物相容性及高的近红外(NIR)光热转换能力等优势。鉴于MoS2纳米片的独特理化性质,近日,中国科学院高能物理研究所研究人员利用MoS2纳米片负载热敏型NO供体BNN6(N,N′-Di-sec-butyl-N,N′-dinitroso-1, 4-phenylenediamine)得到了新型多功能纳米复合物(MoS2-BNN6),构建了时空可控的NO释放纳米平台,实现NO的高效释放及其与近红外光热治疗(PTT)的协同抗菌。一方面,该纳米复合物能够在808 nm激光触发下可控释放NO并协同PTT使得细菌产生氧化/氮化应激,从而方便、快速、有效地抑制革兰氏阴性耐氨苄青霉素大肠杆菌和革兰氏阳性耐热型粪肠球菌。另一方面,MoS2-BNN6的光热效应和温度增强的催化效应使得协同的PTT/NO引起细菌内抗氧化剂谷胱甘肽(GSH)的氧化,打破了GSH的保护平衡并促使细菌内产生更多的活性氧(ROS)和活性氮(RNS)自由基,增强了氧化/氮化应激引起的细菌DNA的损伤。研究还发现,该协同抗菌策略可以有效地消除模型小鼠的表皮炎症伤口的炎症,并促进伤口组织的纤维细胞和胶原蛋白的生成,使得炎症伤口愈合良好。该研究为开发新型纳米抗菌剂实现耐药和耐热型细菌感染的伤口治疗提供了新思路。(来源:MaterialsViews)
