近年来,荧光材料以其独有的优势广泛应用于疾病的诊断当中,其中很多荧光材料又具有光敏剂的效果,产生的活性氧簇(ROS)是其能够作为光动力治疗的重要基础。那么能否通过一种设计将其诊断和治疗的功能合二为一,协同一线抗癌药物,发挥出“辅佐”性质的功效呢?南开大学丁丹教授课题组和香港科技大学唐本忠院士合作,设计出了一种基于“聚集诱导发光”性质的荧光探针,开发出了一种新型的诊疗体系。
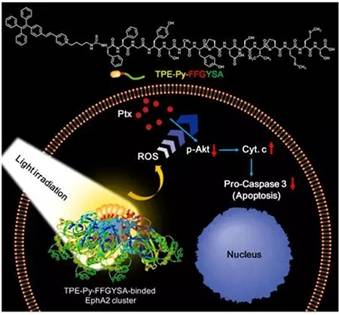
诊疗一体化,因其将影像诊断和疾病治疗有机的整合在一起,能够同时实现两种功能而广泛受到研究者的关注。在各种影像诊断体系中,荧光成像体系因其灵敏度高,生物安全性好,价格便宜而显出极大优势,同时很多荧光材料具有产生活性氧簇(ROS)的能力,从而发挥特定的治疗功效。传统的荧光材料在聚集状态下会产生荧光淬灭,同时也减弱了产生ROS的能力,极大的限制了荧光材料的使用浓度,使得治疗功效不能有效发挥。基于此,在新型诊疗体系中采用了“聚集诱导发光”(Aggregation-induced emission; AIE)材料来制备新的诊疗体系。这种材料在聚集状态下能够有效产生ROS,其发光机制为限制分子内苯环旋转。
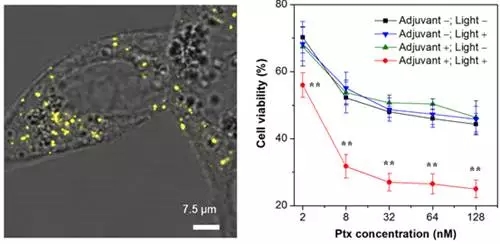
近日,南开大学丁丹教授团队和香港科技大学唐本忠院士团队利用这种AIE荧光材料合成了一种可实现诊疗一体化的荧光探针:TPE-Py-FFGYSA,其中TPE-Py为具有AIE性质的荧光分子,其能够在聚集状态下发出明亮荧光并且有效产生ROS,FFG三肽序列能够诱导探针在疾病部位实现有序自组装,提高了探针的灵敏度和ROS产率,YSA为肿瘤细胞靶向序列,是实现诊断治疗的重要基础。
其中值得关注的是该新型诊疗体系所发挥出的“辅佐”性质的功效。也就是说其本身产生的ROS不对组织细胞造成任何实质性的杀伤或引起细胞凋亡,而在同一线化疗药物紫杉醇的联合使用下能够极大的放大紫杉醇的抗癌效果,将紫杉醇杀伤人前列腺癌细胞的半致死浓度从75.9 nM降低到了7.8 nM,表现出了极高的临床应用价值。其效果唐本忠院士和丁丹教授将其命名为“0+1>1”的协同治疗,并首次在该领域提出这一概念。
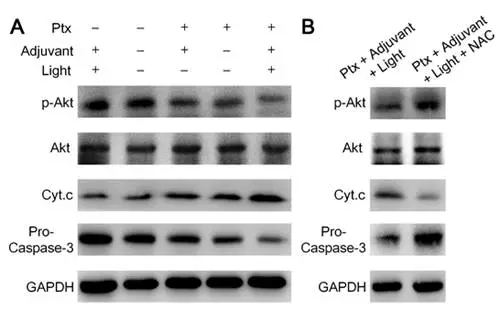
为了探究其潜在的分子机制,他们进一步对细胞中存活和凋亡通路上的关键蛋白进行了提取分析,发现这种探针产生的ROS本身未对其通路上蛋白表达量有实质性的影响,但与抗癌药物紫杉醇协同治疗能够极大程度的抑制肿瘤细胞存活,促进肿瘤细胞的凋亡。从机理上对这一效果进行了解释。
这一研究成果近期发表在《Chemical Science》上,文章的第一作者是南开大学博士研究生陈超和香港科技大学博士研究生宋哲刚。(来源:X一MOL资讯)
